Depuis les grands anatomistes du XIXe siècle, on pensait connaître tous les organes du corps humain. Et Pourtant, il n’en était rien, car grande a été la surprise lorsque les scientifiques ont mis en évidence que l’homme était doté d’un « deuxième cerveau ». La majorité des microbiologistes, gastro-entérologues et autres neurobiologistes s’accordent pour affirmer que l’intestin et ses résidents bactériens sont bien plus qu’un simple conduit, qu’une simple machine à digérer. En effet, nous ne signalons pas moins de 200 millions de neurones présents au niveau de l’intestin. Et il existerait un lien entre système nerveux entérique et système nerveux central. C’est pourquoi la communauté scientifique se penche sur les liens possibles entre un déséquilibre du microbiote intestinal et certains troubles psychiques comme le stress, dépression… etc. Mais aussi des maladies neurodégénératives comme Parkinson, Alzheimer…etc.[1]
il serait donc intéressant de savoir de quelle(s) manière(s) le microbiote de l’organisme humain impacte notre santé physique et mentale ?
Définition du microbiote de l’organisme humain
Le microbiote de l’organisme humain est l’ensemble des micro-organismes (bactéries, levures, champignons, virus) vivant en symbiose dans un environnement spécifique. Dans l’intestin de l’homme, on ne dénombre pas moins de 100 000 milliards de micro-organismes (archées, bactéries, protistes, fungi et virus) qui représentent à eux seul, « le microbiote intestinal humain » ou communément appelé « la flore intestinale », soit au moins dix fois plus que le nombre moyen de cellules de l’organisme selon un article parus dans l’« American Journal of Clinical Nutrition » en 1972. Les bactéries du tube digestif présentes sont dites « mutualistes » car elles interagissent entre elles pour favoriser la survie de chacune d’elle.
Nb : les bactéries sont présentes dans tout le tube digestif (de l’estomac jusqu’à l’anus)
LES 4 GRANDES FONCTIONS DU MICROBIOTE DE L’ORGANISME HUMAIN
-
Fonction trophique :
Le microbiote de l’organisme permet la maturation du tube digestif, notamment sur l’épaisseur de la muqueuse intestinale, la taille des villosités, la production de mucus, la vascularisation épithéliale et l’activité enzymatique de la muqueuse, ainsi que dans la maturation du système immunitaire intestinal.
-
Fonctions métaboliques :
Il faut savoir qu’une fraction des aliments n’est pas digérée par nos propres enzymes digestives et finissent, en fait, par être utilisée dans le Microbiote au niveau du côlon pour rentrer dans le processus de fermentation (notamment les fibres alimentaires). Ce processus de fermentation entraîne la production de gaz, ainsi que de nombreux métabolites, dont des acides gras à chaîne qui sont des nutriments indispensables à nos colonocytes (ou bactéries du microbiote).
-
Fonction immunitaire :
Le Microbiote de l’organisme a aussi un rôle immunitaire en ayant un « effet de barrière » en s’opposant à l’implantation et à la multiplication de bactéries exogènes. De plus celui-ci peut également moduler l’impact de toxines produites par les micro-organismes pathogènes, soit en les dégradant, soit en agissant sur leur synthèse, soit en modifiant la sensibilité de notre paroi intestinale à ces toxines.
-
Nouvelles fonctions :
Il a été mis en évidence que la composition du microbiote aurait un impact sur les allergies ont été mises en évidence chez les enfants allergiques et chez des personnes obèses. Certaines bactéries du microbiote pourraient donc avoir un rôle protecteur et d’autres un rôle inducteur de maladies inflammatoires, métaboliques, voire de troubles comportementaux. [2].
A travers la description de ces fonctions, le Microbiote démontre son importance dans notre santé. En effet, lorsque que le microbiote fonctionne normalement, il nous protège des agressions intestinales et permet au circuit digestif d’être efficace.
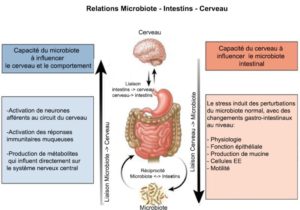
LE LIEN ENTRE CERVEAU ET INTESTIN
Le système nerveux central est en interaction permanente avec le tube digestif. Cette connexion est dite « bidirectionnelle » car elle se fait par les voies nerveuses sympathiques (nerfs splanchniques) et parasympathiques (nerf vague) du système nerveux autonome (SNA).
D’ailleurs il faut savoir que 95% de la sérotonine est produite au niveau de l’intestin et prend part aux échanges entre le cerveau et l’intestin via le nerf vague. La sérotonine est un neurotransmetteur, parfois aussi appelé « hormone de la sérénité » qui régule une vaste gamme de fonctions, notamment l’humeur ou le comportement d’un individu. Mais il existe un troisième acteur : le microbiote intestinal.
Il prendrait part également à ce mystérieux dialogue entre cerveau et intestin. Même si les mécanismes ne sont pas encore clairement élucidés, on sait que le microbiote intestinal agit sur le cerveau, par les voies sanguines et nerveuses via la sécrétion et libération de certaines molécules. Il a été mis en évidence que le microbiote intestinal semble avoir un effet modérateur sur la réponse au stress.
Lors d’une expérience sur des souris axéniques (sans microbiote intestinal), une recherche a montré une hypersensibilité au stress avec une augmentation de la concentration sanguine d’une hormone liée au stress (la corticostérone). En corollaire, d’autres études ont montré que l’administration de « bactéries probiotiques » à des rats et des souris permettait d’atténuer la libération de corticostérone provoquée par des situations stressantes.
De nombreuse autres études ont également constaté des modifications de la composition du microbiote intestinal chez les rongeurs présentant un comportement dépressif. [3] Par exemple, comme l’a démontré, Mme DEANS Emily, psychiatre dans le Massachusetts (USA), les bactéries lactobacillus et bifidobactérium produisent de l’acide Gamma-AminoButyrique » ou « GABA » qui est un facteur de relaxation ou encore les bactéries « Bacillus » et « Serratia » qui produisent de la dopamine qui active les centres du cerveau liés à la récompense et au plaisir. Cette expérience a aussi été constatée aussi chez l’homme. En effet, des patientes souffrant d’une dépression avait aussi une dysbiose (déséquilibre du Microbiote).
Et pour plus de véracité, des chercheurs ont comparé la composition du microbiote intestinal de 37 individus souffrant de dépression à un groupe témoin de 18 individus. Il en résultait une sous-représentation des « Bacteroidetes » qui active la libération de la sérotonine avec une surreprésentation du genre « Alistipes » qui active la libération de corticostérone. L’ensemble de ces recherches suggère que le microbiote intestinal joue un rôle sur nos comportements et notre réactivité émotionnelle. D’ailleurs, récemment, une équipe de chercheurs américains a montré que des femmes ayant consommées durant un mois un produit laitier enrichi en « bactéries probiotiques » accordaient moins d’attention à des stimuli émotionnels négatifs, comme des visages exprimant de la peur ou de l’anxiété.
MICROBIOTE ET MALADIES LIÉES AU CERVEAU [4]
-
La Schizophrénie :
Chez les personnes atteintes de schizophrénie ou de troubles bipolaires, l’équilibre entre les différentes cytokines (moyen de transport des échanges entre cellules) pro-inflammatoires ou anti-inflammatoires dans le sang est perturbé par des marqueurs de translocation bactérienne. Plus vulgairement, l’activité de certaines bactéries influence les messages hormonaux entre cellules.
-
L’autisme :
Il a aussi été montré que des souris pouvaient développer un comportement d’anxiété et une automutilation si la composition de leur microbiote était significativement modifiée durant une période précise de leur croissance. Les chercheurs posent l’hypothèse qu’un phénomène similaire surviendrait chez les enfants et favoriserait le développement de l’autisme.
-
Maladies neurodégénératives :
Dernièrement, des études ont suggéré que le microbiote de l’organisme humain pouvait avoir un rôle déterminant dans les maladies neurodégénératives : il serait impliqué dans l’inflammation cérébrale de la maladie d’Alzheimer. La gravité des symptômes parkinsoniens est aussi corrélée à la concentration d’une espèce de bactérie en particulier :« les Entérobactericeae ».
Tous ces différents phénomènes pourraient être dirigé par des substances d’origine bactérienne « neuroactive » les rendant plus facilement différentiable lors d’une analyse biologique. Ils influenceraient donc le développement des données de « transcriptomique » (expression des gènes) et la gestion « métabolomique » (relatives aux métabolites) et tout en perturber le fonctionnement. [5]
MICROBIOTE ET MALADIES ANABOLIQUES
Lorsque l’on est en bonne santé, notre microbiote intérieur favorise la maturation du système immunitaire intestinal ainsi que la maturation de notre tissu cellulaire intestinal. A savoir qu’il nous permet aussi de bien digérer les glucides, les protéines et les lipides que nous ingérons. Et une autre chose importante, il permet aux systèmes digestifs de fermenter les fibres alimentaires que notre intestin est incapable de digérer. Ainsi, il y aura aussi la synthèse de certaines vitamines essentielles à notre organisme. En cas de dysbiose, c’est‐à‐dire un changement dans la composition ou la stabilité des populations bactériennes de l’intestin, le microbiote peut être associé à des désordres métaboliques tel que le diabète de type 2, l’obésité ou bien les maladies cardiovasculaires. Par ailleurs, certaines composantes du microbiote ont été associées aux maladies telles que la maladie de Crohn ou la rectocolite hémorragique, mais aussi au développement d’allergies et au cancer colorectal. [6]
-
Microbiote et diabète type II:
Les patients diabétiques de type 2 souffrent d’un dysfonctionnement d’action au niveau des récepteurs à l’insuline, l’hormone responsable du maintien constant du taux de sucre dans le sang. Or l’or d’une transplantation fécale chez un individu diabétique provenant d’un Microbiote intestinal d’une personne non diabétique en bonne santé, il a été mis en évidence l’amélioration de la sensibilité à l’insuline. Cet effet métabolique a été associé à un rééquilibrage du microbiote des patients traités. Une étude scientifique israélienne a montré que l’on pouvait prédire l’élévation de la glycémie (la concentration de sucre dans le sang) après un repas en regardant simplement les bactéries présentes dans l’intestin des individus sélectionnés pour l’étude. De plus, les chercheurs ont montré que la digestion d’un même aliment par deux personnes différentes pouvait induire des glycémies complètement différentes. Par exemple, manger une banane va induire une forte élévation de la glycémie chez une personne sans rien modifier chez une autre. Par conséquent, un même aliment n’a pas les mêmes effets sur la santé chez tout le monde car le microbiote l’assimile différemment.
-
Microbiote et obésité :
Différentes conditions de notre environnement (junk food, stress, intolérances alimentaires etc.) peuvent favoriser un déséquilibre de notre microbiote intestinal. La perturbation de l’écosystème intestinal et la perte de la biodiversité bactérienne vont favoriser la pullulation de germes opportunistes. Cette dysbiose peut favoriser une inflammation à bas bruit de la muqueuse intestinale entrainant une altération de la muqueuse intestinale. Cette hyper perméabilité de la muqueuse de l’intestin favorise le passage d’endotoxines bactériennes comme les lipopolysaccharides (LPS) qui vont activer certains récepteurs cellulaires (Toll-like) activant notre immunité innée et aussi favorisant l’insulino-résistance et l’obésité [6-1] [6-2] [6-3]. L’association entre le niveau de LPS et le dosage de l’insuline et des triglycérides a été confirmée chez des patients souffrant de diabète de type 2 et d’obésité [6-4].
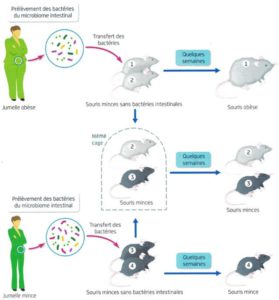
D’autres études, menées chez l’animal par les équipes de Jeffrey Gordon, ont montré que des souris axéniques (sans microbiote intestinal) avaient une adiposité moindre que leurs congénères avec microbiote intestinal et qu’elles restaient minces même avec un régime riche en graisses [7]. Dans la même lignée, les chercheurs de l’INRA de Jouy-en-Josas, ont pu observer que soumises à un régime riche en graisses, les souris axéniques prenaient trois fois moins de poids que les souris normales nourries de la même façon. [8]
Microbiote et Maladie Intestinale Chronique Inflammatoire (M.I.C.I) : [9]
Les chercheurs de l’Université de Göteborg identifient des molécules microbiennes qui déclenchent une sécrétion de mucus protecteur capable de repousser les envahisseurs et de former une barrière de protection aux sites les plus sensibles du tube digestif. Ils démontrent comment ces « cellules sentinelles » gèrent la protection du tube digestif, en détectant les bactéries qui viennent de pénétrer la barrière de mucus protecteur puis déclenche une « cascade » de mucus pour repousser les agents pathogènes. Ces observations ont été menées sur des tissus de souris.*
Le côlon possède deux lignes de défenses : [9-1]
Une couche de mucus qui empêche les mauvaises bactéries d’entrer en contact direct avec le tissu. La couche protectrice de mucus comprend la protéine mucine produite et sécrétée par les cellules dites caliciformes.
Des « Bactéries sentinelles » qui gardent l’entrée des cryptes : en plus de la couche de mucus, première ligne de défense du côlon, une seconde ligne de défense, ce sous-ensemble de cellules caliciformes. L’intestin possède des invaginations ou « cryptes » où sont produit de nouvelles cellules intestinales. Lorsqu’elles détectent des traces de bactéries ennemies, elles déclenchent une réaction inflammatoire pour augmenter la sécrétion du fameux mucus protecteur. Malheureusement, en cas d’insuffisance de sentinelles, l’attaque bactérienne se passe directement au sein des « cryptes », provoquant ces maladies inflammatoires de l’intestin comme par exemple la colite ulcéreuse.
QUE CONCLURE ?
Nous savons désormais que notre cerveau et notre santé intestinal seraient influencés par les milliards de bactéries qui peuplent notre tube digestif. De nombreuses études sont actuellement en cours pour mieux comprendre les liens entre microbiote intestinal et nos émotions mais aussi certaines maladies comme le cancer.
Et il va sans dire que notre régime alimentaire influence la composition de notre Microbiote qui à son tour va interagir avec la santé de nos intestins et de nos émotions.
Ces recherches suscitent de grands espoirs quant à un meilleur diagnostic et accompagnement de ces maladies.
BIBLIOGRAPHIE :
[1] – BIOCODEX, « le microbiote intestinal »,http://www.microbiote-intestinal.fr/description-du-microbiote
[2] – BIOCODEX, « le microbiote intestinal »,http://www.microbiote-intestinal.fr/description-du-microbiote
[3] – INSTITUT DANONE, « microbiote intestinal et obésité », http://institutdanone.org/objectif-nutrition/microbiote-intestinal-et-obesite/dossier-microbiote-intestinal-et-obesite/, [le 04/03/2017]
[4]INSERM, « Microbiote intestinale et santé», http://www.inserm.fr/thematiques/physiopathologie-metabolisme-nutrition/dossiers-d-information/microbiote-intestinal-et-sante , [le 04/03/2017]
[5] – CNRS, « Le microbiote intestinal : un nouvel allié pour une croissance optimale », http://www2.cnrs.fr/presse/communique/4419.htm, [le 04/03/2017]
[6] http://www.lanutrition-sante.ch/surpoids-et-obesite-et-si-cetait-lintestin/ , [le 04/03/2017]
[6-1] Al Attas OS, « Changes in endotoxoin levels in T2DM subjects on anti-diabetic therapies » Cardiovascular diabetology 2009; 8:20, [le 04/03/2017]
[6-2] Semova I. « Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish » Cell Host Microbe 2012 Sep 13; 12(3):277-88, [le 04/03/2017]
[6-3] MArthur R, « Intestinal Methanobrevibacter smithi but not total bacteria is related to diet-induced weight gain in rats » Obesity, 2013 Apr; 21(4):748-54, [le 04/03/2017]
[6-4] Mbakva CA « Gut colonization with Methanobrevibacter smithi is associated with childhood weight development » Obesity, 2015 Dec; 23(12):2508-16, [le 04/03/2017]
[7] Turnbaugh P., Ley R., Mahowald M., Magrini V., Mardis E., & Gordon J. (2006) An obesity-associated gut microbiome with increased capacity for energy harvest – Nature 444, 1027-1031, [le 04/03/2017]
[8] Obésité, la flore intestinale mise en cause, Philippe Gérard – Pour la Science n°447, janvier 2015
[9-1] Science 24 June 2016 DOI: 10.1126/science.aaf7419 A sentinel goblet cell guards the colonic crypt by triggering Nlrp6-dependent secretion Muc2 , [le 04/03/2017]